108552
论文已发表
注册即可获取德孚的最新动态
IF 收录期刊
- 3.4 Breast Cancer (Dove Med Press)
- 3.2 Clin Epidemiol
- 2.6 Cancer Manag Res
- 2.9 Infect Drug Resist
- 3.7 Clin Interv Aging
- 5.1 Drug Des Dev Ther
- 3.1 Int J Chronic Obstr
- 6.6 Int J Nanomed
- 2.6 Int J Women's Health
- 2.9 Neuropsych Dis Treat
- 2.8 OncoTargets Ther
- 2.0 Patient Prefer Adher
- 2.2 Ther Clin Risk Manag
- 2.5 J Pain Res
- 3.0 Diabet Metab Synd Ob
- 3.2 Psychol Res Behav Ma
- 3.4 Nat Sci Sleep
- 1.8 Pharmgenomics Pers Med
- 2.0 Risk Manag Healthc Policy
- 4.1 J Inflamm Res
- 2.0 Int J Gen Med
- 3.4 J Hepatocell Carcinoma
- 3.0 J Asthma Allergy
- 2.2 Clin Cosmet Investig Dermatol
- 2.4 J Multidiscip Healthc

冬凌草甲素负载、GPC1 靶向的金纳米探针用于胰腺癌的多模态成像和治疗
Authors Qiu W, Chen R, Chen X, Zhang H, Song L, Cui W, Zhang J, Ye D, Zhang Y, Wang Z
Received 26 June 2018
Accepted for publication 1 October 2018
Published 24 October 2018 Volume 2018:13 Pages 6809—6827
DOI https://doi.org/10.2147/IJN.S177993
Checked for plagiarism Yes
Review by Single-blind
Peer reviewers approved by Dr Farooq Shiekh
Peer reviewer comments 3
Editor who approved publication: Dr Lei Yang
目的:早期诊断和治疗对于改善胰腺癌患者的预后至关重要。然而,传统的成像技术不能实现早期检测。在本研究中,我们开发了一种多功能诊疗一体化纳米平台,用于准确诊断和有效治疗胰腺癌。
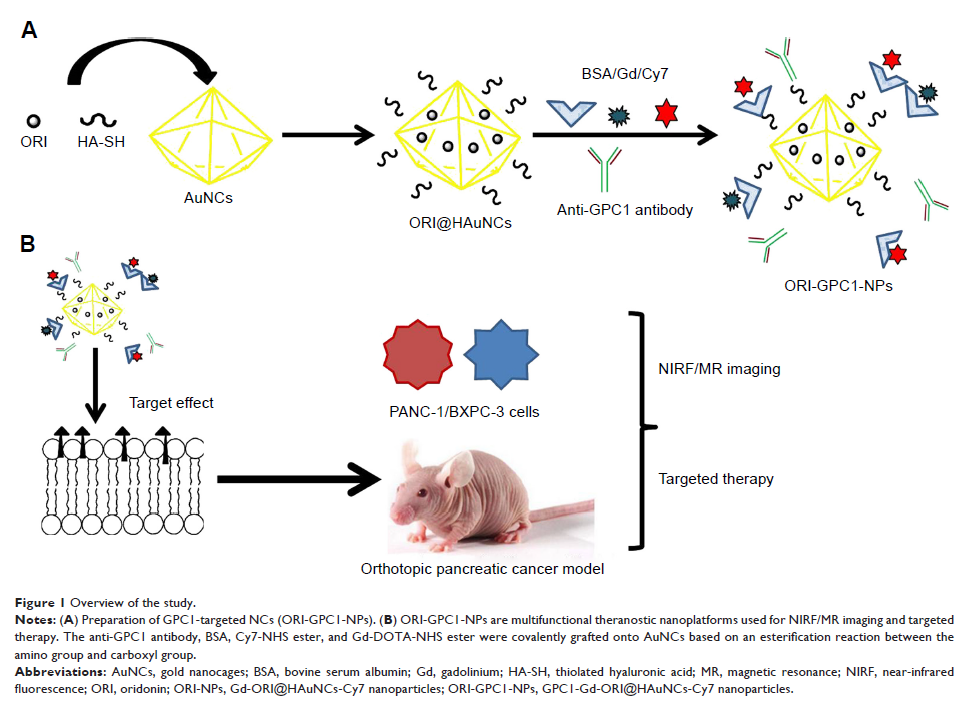
方法:我们基于透明质酸(HA)修饰,以及抗磷脂酰肌醇蛋白聚糖-1(GPC1)抗体,冬凌草甲素(ORI),钆(Gd)和 Cy7 染料缀合的金纳米笼(AuNCs),开发了一种诊疗一体化的纳米模型。 我们评估了 GPC1-Gd-ORI @ HAuNCs-Cy7(ORI-GPC1-NPs)纳米颗粒的性能,包括形态,水流动力学,稳定性和表面化学物质。 我们检测了体外药物负载率和释放率。在体内、外检测了探针近红外荧光(NIRF)/磁共振(MR)成像能力和治疗能力。
结果:ORI-GPC1-NPs 具有长时间的稳定性和荧光/MR 成像特性。生物透射电子显微镜(bio-TEM)显示,PANC-1 和 BXPC-3 细胞(过表达 GPC1)能内吞 ORI-GPC1-NPs 颗粒,但 293T 细胞(GPC1 阴性)中无。与 ORI 和 ORI-NPs 相比,ORI-GPC1-NPs 在体外能显著抑制胰腺癌细胞的活性,增强细胞凋亡。此外,血液学检测显示 ORI-GPC1-NPs 的毒性可忽略不计。体内研究表明,ORI-GPC1-NPs 能够在胰腺癌原位裸鼠模型中实现多模式成像和靶向治疗。
结论:ORI-GPC1-NPs 是可同时实现胰腺癌诊断和有效治疗的一种有前途的诊疗一体化纳米平台。
Keywords: pancreatic cancer, GPC1, ORI, theranostic