108985
论文已发表
注册即可获取德孚的最新动态
IF 收录期刊
- 3.4 Breast Cancer (Dove Med Press)
- 3.2 Clin Epidemiol
- 2.6 Cancer Manag Res
- 2.9 Infect Drug Resist
- 3.7 Clin Interv Aging
- 5.1 Drug Des Dev Ther
- 3.1 Int J Chronic Obstr
- 6.6 Int J Nanomed
- 2.6 Int J Women's Health
- 2.9 Neuropsych Dis Treat
- 2.8 OncoTargets Ther
- 2.0 Patient Prefer Adher
- 2.2 Ther Clin Risk Manag
- 2.5 J Pain Res
- 3.0 Diabet Metab Synd Ob
- 3.2 Psychol Res Behav Ma
- 3.4 Nat Sci Sleep
- 1.8 Pharmgenomics Pers Med
- 2.0 Risk Manag Healthc Policy
- 4.1 J Inflamm Res
- 2.0 Int J Gen Med
- 3.4 J Hepatocell Carcinoma
- 3.0 J Asthma Allergy
- 2.2 Clin Cosmet Investig Dermatol
- 2.4 J Multidiscip Healthc

羟基磷灰石纳米颗粒在人脐带间充质干细胞中的内吞机制和骨诱导特征
Authors Shi XX, Zhou K, Huang F, Zhang J, Wang C
Received 2 November 2017
Accepted for publication 11 January 2018
Published 12 March 2018 Volume 2018:13 Pages 1457—1470
DOI https://doi.org/10.2147/IJN.S155814
Checked for plagiarism Yes
Review by Single-blind
Peer reviewers approved by Dr Govarthanan Muthusamy
Peer reviewer comments 2
Editor who approved publication: Dr Lei Yang
背景:作为一种具有潜力的生物活性材料,纳米羟基磷灰石(nano-HAP)在骨再生中的广泛应用增加了其人体暴露的风险。然而,我们对 nano-HAP 与参与骨修复的干细胞之间的相互作用尚不清楚。
方法:采用脐带沃顿胶来源的间充质干细胞(hWJ-MSCs),研究了羟基磷灰石纳米颗粒(HANPs,20 nm np20 和 80 nm np80)的粘附和内吞特性,揭示了其内吞的途径。此外,我们还探讨了 HANPs 对细胞活力、凋亡和成骨分化的影响及其相关机制。
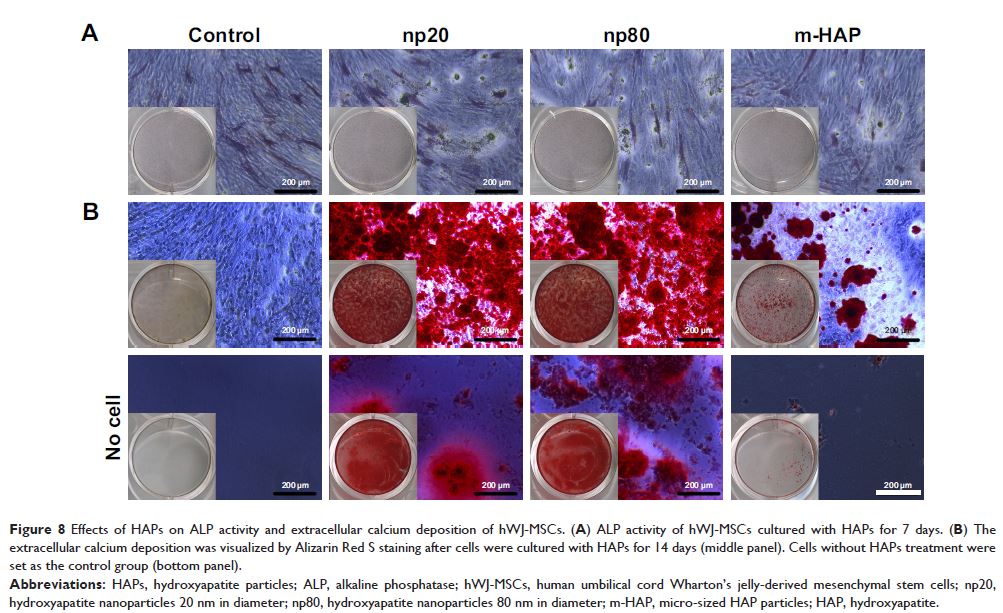
结果:与微米级羟基磷灰石颗粒(m-HAP;12μm)相比,两种 HANPs 更易附着于细胞膜,并转运至细胞内。令人感兴趣的是,虽然 np20 和 np80 粘附和内吞的动力学表现相似,但其内吞途径并不相同。我们的研究发现网格蛋白和小窝蛋白介导的内吞以及巨胞饮都参与了 np20 的摄取。但在细胞摄取 np80 的过程中,网格蛋白介导的内吞和一些尚未明确的摄取途径发挥了重要作用。与 m-HAP 相比,HANPs 更易在细胞质中累积,但并未进入细胞核。细胞暴露于 np20 24 h 后活力明显下降,但延长暴露时间至 72 h,细胞活力能够恢复正常。HANPs 对 hWJ-MSCs 的凋亡和坏死没有不良影响。更重要的是,HANPs 可以通过 JNK 和 p38 两条信号通路促进了 hWJ-MSCs 成骨相关基因的表达以及矿物质的沉积。
结论:我们的研究进一步阐明了 HANPs 与 MSCs 的相互作用,并为揭示 nano-HAP 在硬组织再生中的潜力提供了理论依据。
Keywords: HANPs, hWJ-MSCs, internalization, osteogenic differentiation, JNK,
p38