108985
论文已发表
注册即可获取德孚的最新动态
IF 收录期刊
- 3.4 Breast Cancer (Dove Med Press)
- 3.2 Clin Epidemiol
- 2.6 Cancer Manag Res
- 2.9 Infect Drug Resist
- 3.7 Clin Interv Aging
- 5.1 Drug Des Dev Ther
- 3.1 Int J Chronic Obstr
- 6.6 Int J Nanomed
- 2.6 Int J Women's Health
- 2.9 Neuropsych Dis Treat
- 2.8 OncoTargets Ther
- 2.0 Patient Prefer Adher
- 2.2 Ther Clin Risk Manag
- 2.5 J Pain Res
- 3.0 Diabet Metab Synd Ob
- 3.2 Psychol Res Behav Ma
- 3.4 Nat Sci Sleep
- 1.8 Pharmgenomics Pers Med
- 2.0 Risk Manag Healthc Policy
- 4.1 J Inflamm Res
- 2.0 Int J Gen Med
- 3.4 J Hepatocell Carcinoma
- 3.0 J Asthma Allergy
- 2.2 Clin Cosmet Investig Dermatol
- 2.4 J Multidiscip Healthc

炎性微环境下抗菌肽 β 防御素 3 与金纳米颗粒对人牙周膜细胞成骨分化作用的影响
Authors Zhou J, Zhang Y, Li L, Fu H, Yang W, Yan F
Received 6 September 2017
Accepted for publication 7 December 2017
Published 26 January 2018 Volume 2018:13 Pages 555—567
DOI https://doi.org/10.2147/IJN.S150897
Checked for plagiarism Yes
Review by Single-blind
Peer reviewers approved by Dr Govarthanan Muthusamy
Peer reviewer comments 2
Editor who approved publication: Dr Linlin Sun
目的:在纳米生物界面进行生物物理化学相互作用是一个巨大的挑战,同时也是近年来生物医学、纳米生物技术、化学和材料科学等研究领域的研究热点。抗菌肽作为一种多功能材料,具有可编程执行特定任务的功能。人抗菌肽 β 防御素 3(human β defensing 3, hBD3)作为抗菌肽的一种类型,具有抗菌和促进再生的特性。金纳米颗粒(gold nanoparticles, AuNPs)在组织工程领域显示出很多具有前景的应用价值。然而,hBD3 和 AuNPs 协同作用对人牙周膜细胞(human periodontal ligament
cells,hPDLCs)成骨分化作用的研究较少。因此,本文旨在研究炎性微环境下 hBD3 及 AuNPs 协同作用对 hPDLCs 成骨分化作用的影响,并探索其潜在机制。
方法:培养 hPDLCs,加入大肠杆菌 LPS(E. coli -LPS)、hBD3 和 AuNPs。通过 CCK-8 法检测其对细胞活性的影响,并通过透射电子显微镜(Transmission Electron
Microscope, TEM)观察 AuNPs 进入细胞的情况及对细胞的作用。采用碱性磷酸酶染色(alkaline phosphatase, ALP)、茜素红染色及活性测定观察 hPDLCs 成骨作用。采用 real-time PCR 和 Western blot 技术检测成骨相关及 Wnt/β-catenin 信号通路相关基因和蛋白的表达。
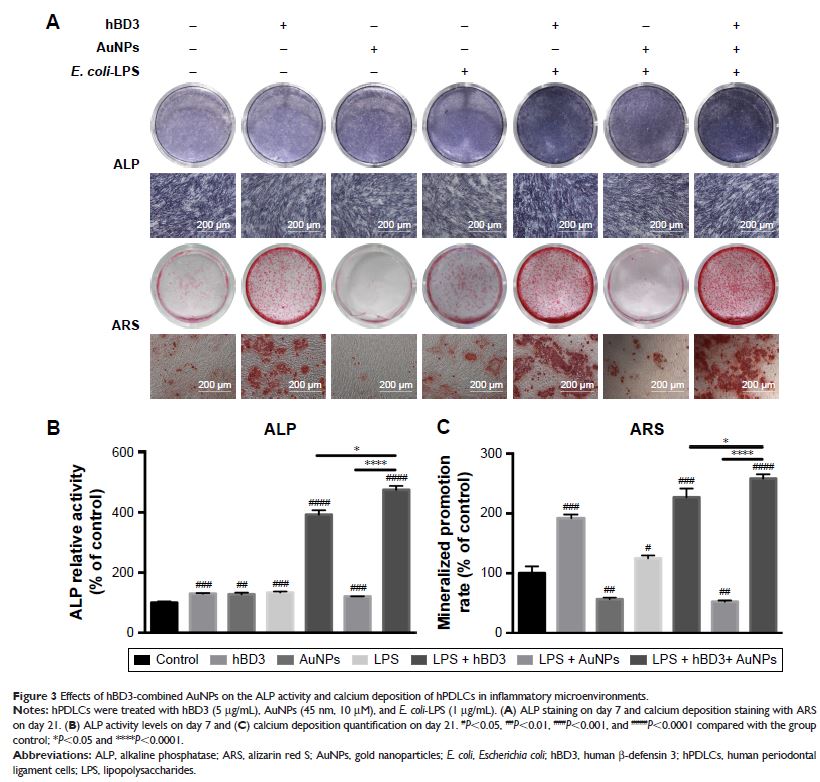
结果:与对照组相比,E. coli -LPS、hBD-3 和 AuNPs 对 hPDLCs 活性均无明显影响;在 E. coli -LPS 刺激下,hBD3 与 AuNPs 协同作用能够显著增强 ALP 活性和矿化结节形成;定量分析结果也显示在 E. coli -LPS 刺激下,hBD3 与 AuNPs 的协同作用所形成的 ALP 和矿化结节数量最多;Real-time PCR 结果显示在 E. coli -LPS 刺激下,hBD3 与 AuNPs 协同作用能够显著上调成骨相关基因 ALP,Runt 相关转录因子 2(runt-related transcription factor
2, Runx-2)和 I 型胶原蛋白(collagenase-I, COL-1)mRNA 表达,同时也能上调 Wnt/β-catenin 靶基因 cyclin D1表达。Western blot 结果也同样证实,成骨相关蛋白 ALP、Runx-2、COL-1 及 Wnt/β-catenin 信号通路相关蛋白 β-catenin 和 cyclin D1 的表达在 hBD3 与 AuNPs 协同作用下均上调。而加入 Wnt/β-catenin 通路抑制剂 ICG-001 后,hPDLCs 内的 β-catenin 和 cyclin D1 的蛋白表达显著下降,cyclin D1 基因表达也被下调。此外,E. coli -LPS 刺激下,hBD3 与 AuNPs 协同作用组的 ALP 和矿化结节形成也被抑制,成骨相关基因和蛋白 ALP、COL-1 和 Runx-2 表达亦呈现下调趋势。
结论:hBD3 与 AuNPs 协同作用对 hPDLCs 成骨分化具有促进作用,并可上调 Wnt/β-catenin 信号通路靶基因 cyclin D1 的表达。ICG-001 明显抑制 hBD3 与 AuNPs 协同作用上调的 β-catenin 和 cyclin D1 的表达,同时还抑制 hBD-3 与 AuNPs 的协同作用所促进的 hPDLCs 的矿化结节和成骨相关基因 ALP、COL-1 和 Runx-2 基因表达上调,表明 Wnt/β-catenin 信号通路参与 hBD3 与 AuNPs 促进 hPDLCs 成骨分化的调控过程。
Keywords: hBD3, gold nanoparticles, periodontal
ligament cells, osteogenesis, inflammatory microenvironments, Wnt/β-catenin
signalling